



Oleamid (cis-9,10-oktadecenoamid) to cząsteczka wytwarzana endogennie z kwasu oleinowego (kwas tłuszczowy omega-9, o którym wiadomo, że jest kojarzony głównie z oliwą z oliwek) i po raz pierwszy wyizolowana z ludzkiej surowicy w 1989 roku. Wydaje się, że oleamid gromadzi się w mózgu i płynie mózgowo-rdzeniowym (CSF) podczas deprywacji snu, z przedłużeniem braku snu o 6 godzin poza normalny czas snu, powodując 4-6-krotny wzrost zawartości oleamidu w CSF i prawdopodobnie ma to znaczenie wszystkich badanych gatunków, ponieważ oleamid jest powszechny wśród gatunków.
Poza endogenną syntezą oleamidu wykryto go w Ziziphus jujuba.
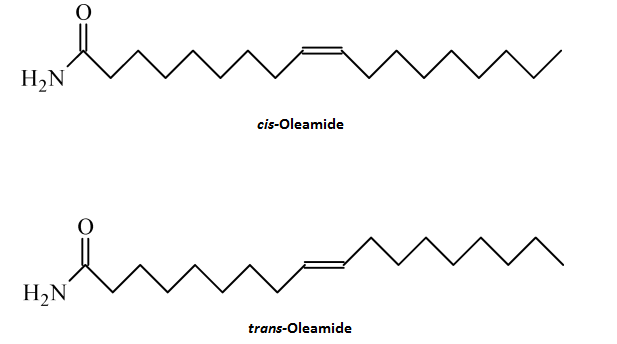
Oleamid odnosi się zwykle do cis-oleamidu[5], a izomer trans wydaje się niezdolny do pośredniczenia w licznych biologicznych wpływach na połączenia szczelinowe, receptory serotoninowe (5-HT2A i 5-HT2C), i receptory GABAA. Skuteczność w stosunku do receptora 5-HT1A jest ograniczona, z około połową skutecznością niż izomer cis, a wstrzyknięcia izomeru trans wydają się być w około połowie tak skuteczne, jak izomer cis.
Odnotowano, że oleamid jest syntetyzowany w wycinkach mózgu inkubowanych zarówno z kwasem oleinowym, jak i amoniakiem, w którym pośredniczą enzymy, ponieważ gotowanie wycinków mózgu (enzymy denaturujące) znosiło syntezę.
Oleamid może zostać rozłożony do kwasu oleinowego przez enzym błonowy hydrolazy amidowej kwasu tłuszczowego (FAAH), ten sam enzym, który metabolity anandamidu (arachidonoiloetanoloamid) i bioaktywne w marihuanie.Co ciekawe, zauważono, że hamowanie tego enzymu hamuje syntezę oleamidu (mysie komórki N18TG2), chociaż dokładna droga biosyntezy nie została jeszcze ustalona. Wydaje się, że wiadomo, że kwas oleinowy jest przekształcany w oleoilo-CoA, a następnie w N-oleoiloglicynę, gdzie oksydacyjne rozszczepienie N-oleoiloglicyny przez enzym monooksygenazę α-amidującą peptydyloglicynę (PAM) tworzy oleamid. Należy zauważyć, że produkt pośredni N-oleoiloglicyna wydaje się być również biologicznie aktywny.
1. JELITA
4 godziny inkubacji w 37°C nie wydają się strukturalnie uszkadzać oleamidu, chociaż wprowadzenie kwasów żółciowych jest w stanie przyspieszyć metabolizm i zniszczyć 95% oleamidu w tych samych warunkach
2. SERUM
Podstawowe poziomy oleamidu w surowicy u ludzi wydają się wynosić około 31,7 μg/ml (110 μM)[18] lub niższe (9,9 μg/l (35nM)[19] i 16 μg/l (56nM) [20]) oraz u myszy Stężenie komórek nerwiaka niedojrzałego wydaje się wynosić 1,5 μg/109 komórek
1. Wzrost nastroju
Oleamid aktywuje receptory serotoninowe, wywołując efekt poprawiający nastrój. Co ciekawe, receptory serotoninowe aktywowane przez oleamid to te same podtypy receptorów, które są aktywowane przez klasę biochemikaliów znanych jako psychedeliki.
W szczególności są to te same receptory, które aktywowane są przez substancje takie jak psilocybina, meskalina i inne związki psychoaktywne. Możliwe, że oleamid działa jak naturalnie wytwarzany związek psychodeliczny – zwiększając kreatywność i umożliwiając wyrażanie różnych wzorców myślowych.
** Dla maniaków nauki: oleamid działa najlepiej na receptory 5-HT2A, 5-HT2C i 5-HT1A. Chociaż oleamid zwiększa działanie tych receptorów, wydaje się, że nie wpływa na wiązanie serotoniny. Proponowany mechanizm działania polega na zwiększonej sygnalizacji postreceptorowej, niezależnej od wiązania serotoniny.
Chociaż te podtypy receptorów są związane z efektami psychoaktywnymi, wiadomo również, że poprawiają nastrój. Receptory 5-HT2A i 5-HT1A są szczególnie istotne dla nastroju i były wykorzystywane jako cele w badaniach klinicznych dotyczących zaburzeń nastroju. Wiadomo, że aktywacja tych podtypów receptorów — podobnie jak oleamid — wspiera zdrowy nastrój.
Wiadomo, że oleamid ma silne działanie poprawiające nastrój poprzez interakcje z receptorami serotoninowymi
2. Efekt relaksacyjny
Oleamid działa również poprzez wpływ na receptory GABA w mózgu. Receptory GABA są celem związków uspokajających i przeciwlękowych ze względu na ich naturalne działanie relaksujące i uspokajające na organizm.
Hormon GABA jest znany jako naturalny neuroprzekaźnik depresyjny organizmu. Oznacza to, że osłabia sygnały z Ośrodkowego Układu Nerwowego, co skutkuje lepszym odprężeniem. Podobny efekt uspokajający mają związki aktywujące receptory GABA.
Wykazano, że oleamid aktywuje receptory GABA nawet w bardzo niskich stężeniach. Aktywność receptora GABA wzrasta średnio o około 220% przy umiarkowanych dawkach oleamidu. Uważa się, że ta zwiększona aktywność powoduje bardzo zauważalną zmianę nastroju, w tym łagodzenie stresu i relaksację.
3. Wpływ na sen
Oleamid świetnie pomaga w zasypianiu
Uważa się, że oleamid działa bardziej jako synergetyk z receptorami GABA niż bezpośredni aktywator receptora GABA. Nie zmienia sposobu, w jaki GABA wiąże się z receptorami, nawet przy wysokich dawkach.
Niezależnie od tego wykazano, że oleamid ma pozytywny wpływ na sen. Wydaje się, że suplementy oleamidowe są w stanie skrócić czas zasypiania, a także poprawić jakość snu.
W dość wysokich dawkach oleamid jest w stanie zmniejszyć koordynację ruchową. Nie zaleca się prowadzenia pojazdów ani obsługiwania maszyn podczas stosowania oleamidu, ponieważ może to powodować senność/senność w dużych dawkach.
4. Poprawa uczenia się
Z jednej strony wielką zaletą suplementów oleamidowych jest to, że mogą one poprawiać zdolności uczenia się. Zostało to wykazane w badaniach na zwierzętach, ale nie zostało jeszcze ostatecznie zbadanych na ludziach.
Jednak unikalna interakcja z receptorami serotoninowymi wskazuje, że oleamid może mieć zdolność do zmiany procesów myślenia – pozwalając na bardziej kreatywne i „nieszablonowe” myślenie. Zostało to potwierdzone w badaniach na zwierzętach, w których oleamid w umiarkowanych dawkach wykazał poprawę w nauce.
Z drugiej strony badania wykazały, że oleamid może mieć niewielki przejściowy negatywny wpływ na pamięć krótkotrwałą. Efekty te zanikają po całkowitym metabolizmie oleamidu — w ciągu 24 godzin. Uważa się, że jest to wynik interakcji oleamidu z receptorami kannaboidalnymi w mózgu.
Tak więc, chociaż oleamid może mieć zdolność do poprawy uczenia się i koncentracji, może również nieznacznie osłabiać pamięć krótkotrwałą na czas trwania swoich efektów.
Badania sugerują, że oleamid może pomóc w nauce
5. Zwiększony apetyt
Badania na zwierzętach wykazały, że łagodne do umiarkowanych dawki oleamidu mają pozytywny wpływ na pobudzenie apetytu. Naukowcy zasugerowali, że zwiększony apetyt jest powiązany z wpływem oleamidu na receptory kannaboidowe.
6. Efekty psychoaktywne
Jednym z ważnych aspektów oleamidu jest to, że wiąże się on z receptorami kannabinoidowymi w mózgu. Są to te same receptory, z którymi wiążą się związki w niektórych roślinach psychoaktywnych podczas palenia lub jedzenia.
Co ważne, oleamid wchodzi w interakcje z receptorami kannabinoidowymi CB1 i CB2 w mózgu. Receptory te pełnią bardzo różne funkcje, z których obie można uznać za korzystne.
Z jednej strony receptor CB1 jest uważany za główny receptor dla wszystkich związków kannabinoidowych i pośredniczy w psychoaktywnych doznaniach odczuwanych przez użytkowników roślin zawierających substancje chemiczne, takie jak THC i inne naturalne kannabinoidy.
Badania wykazały, że oleamid w dużych dawkach ma znaczący wpływ na receptor CB1. W rezultacie naukowcy zasugerowali, że oleamid jest rodzajem cząsteczki zwanej endokannabinoidem — odnosząc się do związku kannabinoidowego wytwarzanego w organizmie.
Z drugiej strony receptor CB2 bierze udział w działaniu przeciwzapalnym mózgu. Naukowcy wykazali, że wiążąc się z tym receptorem, oleamid może wywierać silne działanie przeciwzapalne, zwłaszcza w mózgu. Uważa się, że pomaga to chronić mózg przed stresem i toksynami.
Ponadto wykazano, że oleamid zmniejsza stan zapalny poprzez inne mechanizmy działania w organizmie. Badanie z 2010 roku opublikowane w Journal of Neuroscience Letters wykazało, że oleamid był w stanie zmniejszyć liczbę markerów stanu zapalnego zarówno w mózgu, jak i w całym ciele.
Oleamid świetnie pomaga w zasypianiu i uważa się, że w wyższych dawkach wywołuje pewne efekty psychoaktywne
Dawkowanie oleamidu znacznie się różni. Zalecana dawka wynosi od 50 do 200 mg na dzień. Jednak niektórzy ludzie przyjmują nieco wyższą dawkę, aby uzyskać bardziej wyraźne efekty. Aby uzyskać więcej informacji o tym, jak zażywać oleamid, zapoznaj się z naszym interesującym artykułem tutaj!
W badaniach na zwierzętach naukowcy wykazali, że oleamid LD-50 (dawka, przy której ginie połowa populacji) przekracza 1000 mg/kg masy ciała.
Oleamid jest szybko metabolizowany w organizmie i ma krótki okres półtrwania. Jednak wciąż brakuje badań nad maksymalną dawką dla ludzi.
1. MECHANIZMY
Wiadomo, że anandamid aktywuje receptor TRPV1, ale nie jest znana interakcja z oleamidem; podawanie antagonisty TRPV1 (kapsazepina) nie wydaje się zmieniać behawioralnych efektów oleamidu.
Stwierdzono, że oleamid hamuje transfer barwnika między izolowanymi komórkami glejowymi wyrażającymi α1koneksynę a komórkami wyrażającymi β1koneksynę z maksymalną skutecznością przy 50 μM, ale nie wydaje się hamować propagacji fali Ca2+; ten ostatni został skutecznie zablokowany przez kwas 18β-glicyretynowy (bioaktywny lukrecji), klasyczny inhibitor połączeń szczelinowych.[6] Nie jest pewne, czy te efekty występują w organizmie z powodu wymaganego wyższego stężenia, ale jeśli wystąpią, mogą leżeć u podstaw bardzo nieznacznego działania przeciwpadaczkowego.
Wydaje się, że oleamid wchodzi w interakcję z kanałami sodowymi w neuronach (kanały sodowe wysokiego napięcia są ważne dla neuronalnych potencjałów czynnościowych), ponieważ może blokować depolaryzację wywołaną przez weratrydynę niezależnie od wpływania na sygnalizację potasową (IC50 13,93 μM) i był w stanie zmniejszyć wywołany przez weratrydynę skok napływu wapnia bez wpływu na stężenia podstawowe. Zaobserwowano również działanie hamujące wobec batrachotoksyny A (na kanałach wrażliwych na tetradotoksynę) i, ze względu na rosnącą dysocjację bez wpływu na stałą asocjacji, uważa się, że oleamid allosterycznie moduluje kanał. Zakres stężeń, w których działa (3,2-64 μM) przy tych samych stężeniach, w których działa na receptory GABA i glicyny, sugeruje, że może przyczyniać się do efektów depresyjnych.
Odnotowano również, że cis-oleamid hamuje długotrwałe, powtarzalne wypalanie przy EC50 wynoszącym 4,1 μM i uważa się, że jest to związane z hamowaniem kanałów sodowych.
2. NEUROTRANSMISJA SEROTONINERGICZNA
Na receptorach 5-HT2A, 10-300 nM oleamidu jest w stanie wzmocnić sygnalizację receptora indukowaną przez serotoninę, jak oceniono za pomocą hydrolizy fosfoinozytydu, przy czym 100 nM powoduje 228% zwiększony efekt sygnalizacji bez wpływu na sygnalizację per se. To wzmocnienie na 5-HT2A (165-170% przy 100-1000nM w innym badaniu) zostało powtórzone i wykazano, że rozciąga się na 5-HT1A i 5-HT2C (360-570% przy 100- 1000nM) o stężeniach tak niskich jak 1nM z widocznym efektem[7] bez znaczącego wpływu na receptory 5-HT3. Oleamid nie wpływa na wiązanie ligandów serotoniny z receptorami 5-HT.
Powyższy efekt wzmacniający nie wydaje się wynikać z modyfikacji wartości EC50 serotoniny (która jest niezmodyfikowana), ale wydaje się wynikać ze wzmocnienia sygnalizacji postreceptorowej niezależnej od skuteczności wiązania serotoniny. Dodatkowo, wszystkie te efekty wydają się być krytycznie zależne od nienasyconego wiązania omega-9, ponieważ modyfikacja tego amidu tłuszczowego omega-9 w omega-6 odwraca jego właściwości wzmacniające, podczas gdy nasycenie wiązania je znosi.
Na receptory 5-HT7 oleamid może działać jako bezpośredni agonista z wartością EC50 4,2 nM przy braku serotoniny. Sama serotonina miała wartość EC50 wynoszącą 52 nM i okazało się, że oleamid (w obecności serotoniny) działał jako konkurencyjny inhibitor receptora 5-HT7 (w szczególności antagonista nie do pokonania).Wpływ zarówno serotoniny, jak i oleamidu na receptor był hamowany przez ketanserin o około 65, a oleamid określono, że nie wiąże się z klasycznym miejscem wiązania na receptorach 5-HT7.
Wstępne leczenie fluksetyną lub fenfluraminą (inhibitory wychwytu zwrotnego serotoniny) jest w stanie zahamować wzrost snu obserwowany w przypadku oleamidu, podobnie jak agoniści 5-HT1A Busiprone i 8-OH-DPAT, pomimo tego, że ta ostatnia klasa z natury nie wpływa na sen. Antagonista 5-HT1A WAY100635 nie nasilał snu wywoływanego przez oleamid, ale zapobiegał zmniejszaniu przez inne środki indukcji snu przez oleamid.
3. NEUROTRANSMISJA GLUTAMINERGICZNA
Oleamid nie wydaje się mieć dużego powinowactwa do receptorów glutaminergicznych, w tym NMDA, AMPA i metabotropowych receptorów glutaminergicznych.
4. NEUROTRANSMISJA GABAERGICZNA
Wiadomo, że oleamid wzmacnia prądy zależne od GABAA z wydajnością tak niską jak 3,2 μM i w sposób odwracalny.[32][32] Ta pozytywna modulacja jest widoczna tylko w przypadku izomeru cis-oleamidu, ponieważ forma trans jest nieaktywna,[30][30], a receptory GABAA zawierające podjednostki β1 (które mogą być niewrażliwe na niektóre leki depresyjne) są nadal pozytywnie modulowane przez oleamid.
Maksymalne wzmocnienie sygnalizacji GABAA osiąga 216 +/-35% wartości wyjściowej i ma EC50 wynoszące 28,94 +/- 1,4 μM, a gdzie indziej odnotowano dwukrotny wzrost przy niższych wartościach EC50 (15 μM).
Oleamid nie wpływa znacząco na wiązanie ligandów z receptorami GABAA, ani na wychwyt GABA do synaptosomów.
5. NEUROTRANSMISJA GLICYNERGICZNA
Wydaje się, że oleamid pozytywnie wpływa na receptory glicyny w taki sam sposób, jak receptory GABA, z maksymalnym wzmocnieniem do 171% wartości wyjściowej i EC50 22,12 μM, przy czym EC50 działającej na ten receptor glicyny jest zmniejszone z 322,2 μM do 239,4 μM .
6. NEUROTRANSMISJA CHOLINERGICZNA
Oleamid nie wykazał znaczącego powinowactwa do muskarynowych receptorów cholinergicznych.
Acetylotransferaza choliny (najczęściej cytozolowy enzym syntezy acetylocholiny) jest aktywowana przez oleamid i roślinę, z której pochodzi, ziziphus jujuba
7. SEDACJA I SEN
Pod względem mechanicznym oleamid nie wydaje się mieć dużego powinowactwa do receptorów GABAA, chociaż wykazano, że wzmacnia sygnalizację za pośrednictwem receptora GABAA in vitro, co wydaje się mieć również zastosowanie do samego kwasu oleinowego ( kwestionowana). Oleamid nie zmienia wiązania GABA z receptorem benzodiazepinowym GABAA w stężeniach do 50 mM.
Wiadomo, że oleamid po wstrzyknięciu dożylnym indukuje zależną od dawki indukcję snu z towarzyszącym spadkiem czuwania i latencji snu (czas potrzebny do zaśnięcia) oraz zależnym od dawki spadkiem temperatury ciała.[38] Zastrzyki 25, 50 i 100 mg/kg oleamidu zmniejszają opóźnienie snu odpowiednio o 13, 24 i 33%, podczas gdy 200 mg/kg zmniejsza o 28% (zależność od dawki nie występuje przy tej dawce).
W otwartym teście lokomotoiny ED50 (dawka powodująca połowę obserwowanego efektu) zmniejszenia lokomocji wydawała się być iniekcją 17 +/- 1,5 mg / kg [2], a inne badanie odnotowało ED50 10-19 mg /kg. Inne badania wykazały zależne od dawki zmniejszenie aktywności lokomotorycznej przy dawkach iniekcji tak niskich, jak 2,5 mg/kg [38], a po wstrzyknięciu zmniejszenie zdolności poruszania się wydaje się trwać do 60 minut (największa skuteczność po 30 minutach) i jest znormalizowane. godzin po wstrzyknięciu.
Ta lokomocja indukowana przez oleamid jest dalej redukowana o 70% przy wstępnym traktowaniu antagonistą 5HT1A, podczas gdy jest częściowo odwracana (77%) przez antagonistę D2.
W odniesieniu do snu REM, zastrzyki 25-200 mg/kg oleamidu u szczurów nie wpłynęły znacząco na sen REM , a niższe dawki (2,5-20 mg/kg) również nie zwiększają REM pomimo zmniejszenia opóźnienia snu. Jedno z badań odnotowało wzrost snu REM przy jednorazowych i 15-dniowych wstrzyknięciach oleamidu (25 mcg) domózgowo,, ale jest to najmniej praktyczna metoda badawcza, jaką stosowano (przy ocenie, jak działa suplementacja doustna).
8. PAMIĘĆ I UCZENIE SIĘ
Wiadomo, że pod względem mechanicznym aktywacja receptora CB1 zaburza długoterminowe wzmocnienie (LTP) w hipokampie i chociaż 32µM oleamidu nie jest w stanie per se wpływać na podstawowe LTP, zauważono, że osłabia wyższe niż przeciętne LTP .
Zastrzyki 5 mg/kg oleamidu myszom przed zadaniem przestrzennego uczenia się (labirynt Y) odnotowały poprawę wydajności, której nie zaobserwowano przy 10 mg/kg.
W teście biernego unikania u szczurów zauważono, że wstrzyknięcia 30-50 mg/kg oleamidu ułatwiają wygaszanie pamięci bez widocznego wpływu na przywoływanie pamięci 24 godziny po badaniu. Ten test zauważył, że obserwowane efekty występowały również w przypadku kannabinoidów, w tym ananadamidu, a ponieważ działanie ananadamidu jest blokowane przez agonistów CB1, uważa się, że ten receptor pośredniczy w możliwych amnezyjnych skutkach oleamidu. Stwierdzono również, że pamięć robocza jest osłabiona w przypadku oleamidu (jak również ananadamidu), co nasila się w sytuacjach, gdy degradacja oleamidu jest zmniejszona.
0,16-0,32% diety przez cztery tygodnie (myszy; łącznie 14-16mg dziennie), ponieważ oleamid jest w stanie nieznacznie złagodzić amnezyjne skutki skopolaminy
9. STANY LĘKOWE
W teście interakcji społecznych szczura i podniesionym labiryncie plus, zastrzyki oleamidu w dawce 5 mg/kg, które były zbyt niskie, aby wpłynąć na ruchliwość, mogły wywołać działanie przeciwlękowe.
10. DEPRESJA
Podawanie 10 mg/kg oleamidu samcom myszy wydaje się wywierać działanie przeciwdepresyjne w teście wymuszonego pływania, przy czym 5 mg/kg jest nieskuteczne i żadna dawka nie wpływa na samice myszy.
11. BÓL
Zanotowano pewne efekty przeciwbólowe występujące w przypadku oleamidu, ale 10-75 mg/kg wydawało się zawodne i niezbyt silne we wstępnym teście na gorącej płycie szczura, chociaż okazał się obiecujący w teście trzepania ogonem. Ta umiarkowana skuteczność działania przeciwbólowego trwała do 60 minut, a w innych miejscach stwierdzono, że 50 mg/kg (ale nie 30 mg/kg) zwiększa opóźnienie trzepnięcia ogonem przez godzinę, a następnie znika. To ostatnie badanie potwierdziło brak działania przeciwbólowego w teście gorącej płyty.
Ponieważ uważa się, że test trzepania ogonem odzwierciedla znieczulenie rdzeniowe, a test gorącej płytki nadrdzeniowego, sugeruje to selektywne działanie przeciwbólowe oleamidu.
12. STANY ZAPALNE I UKŁAD KANABINOIDOWY
W mysich komórkach mikrogleju (komórki nerwowe), oleamid jest w stanie tłumić aktywację indukowaną przez LPS (ocenianą przez tlenek azotu i PGE2) przy 10 μM i prawie całkowicie znosić aktywację mikrogleju przy 100 μM. To, jak również zniesienie wytwarzania reaktywnych gatunków tlenu (ROS) w komórkach, było spowodowane hamowaniem transaktywacji PI3K/Akt i NF-kB, które znajdowały się w dół od receptora kannabinoidowego 2 (CB2); blokowanie receptora CB2 znosi przeciwzapalne działanie oleamidu. Sam kwas oleinowy ma również działanie przeciwzapalne, ale słabsze i nie pośredniczy przez receptor CB2.
Receptor CB2 jest wyrażany w mikrogleju i wcześniej wykazano, że wywiera działanie przeciwzapalne i neuroprotekcyjne w mikrogleju.
Odnotowano, że oleamid zapobiega wiązaniu agonistów (CP55,940 i rimonabant) do receptora CB1 bez znaczącego wpływu na powinowactwo wiązania CB2. Istnieje pewna aktywacja receptora CB1 obserwowana w przypadku oleamidu, ale jest to również znoszone przez koinkubację rymonabantu. Argumentowano jednak, że efekty te nie są istotne ze względu na wysokie stężenia stosowane in vitro (10 μM), których nie można osiągnąć po spożyciu doustnym.
13. POTENCJAŁ UZALEŻNIAJĄCY
Oleamid został zbadany pod kątem jego potencjalnie uzależniających właściwości, ponieważ wiadomo, że wzmacnia sygnalizację na receptorach GABAA, co jest efektem farmakologicznym leków benzodiazepinowych (poprzez miejsce wiązania benzodiazepiny zlokalizowane na receptorach GABAA).).
Test, w którym podawano oleamid przez 10 dni (30 mg/kg dwa razy dziennie szczurom), a następnie nagle przerywano leczenie, nie znalazł dowodów na odstawienie, ponieważ objawy odstawienia nie różniły się między stanem oleamidowym a kontrolą. Jednoczesne podawanie antagonistów CB1 wydaje się powodować objawy odstawienia z wyżej wymienionym schematem dawkowania, ale są one w mniejszym stopniu niż opiaty i anandamid.
Podawanie oleamidu przez 15 dni, po którym nastąpiło nagłe zaprzestanie, nie wydaje się mieć negatywnego wpływu na sen w porównaniu ze szczurami kontrolnymi, chociaż poprawa snu REM obserwowana przy leczeniu oleamidem została utracona.

Zaloguj sie