



Inaczej 4'DMA-7,8-DHF (4'-dimetyloamino-7,8-dihydroksyflawon) - syntetyczna pochodna tropoflawiny, selektywny drobnocząsteczkowy agonista TrkB, głównego receptora neurotroficznego czynnika pochodzenia mózgowego (BDNF). W badaniach in vitro i in vivo wykazywała wyższą aktywność agonistyczną w TrkB oraz dłuższy czas działania niż 7,8-DHF.
Aby porównać aktywację TrkB przez te syntetyczne związki, przygotowano pierwotne hodowle korowe i potraktowano je 500 nM różnych związków przez 15 minut i zebraliśmy lizaty komórkowe. Analiza Phospho-Akt ELISA wykazała, że 4'-dimetyloamino-7,8-dihydroksyflawon (związek #6, 4'-DMA-7,8-DHF) i 7,8-dihydroksy-2(pirymidyn-5-ylo)-4H -chromen-4-on (związek nr 8) silnie aktywował Akt, a następnie 4'-fluoro-7,8-DHF (związek nr 7). Jednak 2-(4-fluoro-fenylo)-7,8-dihydroksychinolin-4(1H)-on (związek nr 13) i 7,8-dihydroksy-2-fenylochinolin-4(1H)-on (związek nr 14 ) nie wywołał aktywacji Akt, co wskazuje, że tlen w środkowym pierścieniu C jest niezbędny do agonistycznego efektu 7,8-DHF wobec TrkB (Figura 3A i B). Dane te sugerują, że zastąpienie tlenu przyjmującego wiązania wodorowe NH oddającym wiązanie wodorowe znosi jego działanie stymulujące. Aby ilościowo porównać aktywność pomiędzy 4'-DMA-7,8-DHF i 7,8-DHF, przeprowadzono test miareczkowania. Zarówno 7,8-DHF, jak i 4'-DMA-7,8-DHF wyzwalały aktywację Akt przy stężeniach tak niskich jak 10 nM, a aktywność Akt stopniowo wzrastała wraz ze wzrostem stężenia leku. Jednak 4'-DMA-7,8-DHF wykazywał silniejszą aktywność niż 7,8-DHF przy 10 i 50 nM. Przy stężeniu 100 nM lub wyższym, p-Akt ELISA przez 4'-DMA-7,8-DHF był nieznacznie obniżony i wykazywał aktywność porównywalną do 7,8-DHF. Efekt ten może być spowodowany innymi nieznanymi szlakami aktywowanymi przez 4'-DMA-7,8-DHF, który hamuje aktywację Akt przy wyższym stężeniu (Figura 3B, prawe panele). Immunoblot fosforylacji TrkB korelował z obserwowanym wzorcem aktywacji Akt (rysunek uzupełniający 2). Aby dalej badać kinetykę 4'-DMA-7,8-DHF na aktywację TrkB, potraktowano neurony pierwotne w różnych punktach czasowych. 4'-DMA-7,8-DHF szybko aktywował TrkB już po 5 min, a sygnał nieznacznie obniżył się po 10 min i zanikał z powrotem do linii podstawowej po 30 ~ 180 min (Rysunek 3C, górny lewy panel). Ponownie, wzór aktywacji Akt pojawia się czasowo połączony z aktywacją TrkB (Figura 3C, trzeci lewy panel). Jednak fosforylacja MAPK osiągnęła szczyt po 10 minutach (Figura 3C, 4 lewy panel). Aby porównać stymulujący wpływ na receptor TrkB w mózgu myszy, podano doustnie 1 mg/kg tych związków myszom C57BL/6J i monitorowano aktywację TrkB w różnych punktach czasowych. Wyraźnie widać, że oba związki wywoływały aktywację TrkB (p-TrkB 706) po 1 godzinie, a aktywność TrkB stopniowo narastała z czasem. Aktywacja TrkB wyzwalana 7,8-DHF osiągnęła szczyt po około 1~2 godzinach, podczas gdy 4'-DMA-7,8-DHF osiągnęła szczyt po 4 godzinach i częściowo zanikła po 8-16 godzinach. Efektory niższego rzędu Akt i MAPK były silnie aktywowane przez oba związki. Zgodnie z oczekiwaniami, zarówno p-Akt, jak i p-MAPK aktywowane przez 4'-DMA-7,8-DHF były silniejsze niż 7,8-DHF, a sygnały trwały dłużej dla 4'-DMA-7,8-DHF niż 7 ,8-DHF (rysunek 3C, środkowe panele). Analiza ilościowa z użyciem p-Akt 473 ELISA również potwierdziła, że 4'-DMA-7,8-DHF był silniejszy niż 7,8-DHF w wyzwalaniu aktywacji Akt w mózgu myszy (Figura 3C, prawy panel). Zatem 4'-DMA-7,8-DHF ma wyższy efekt agonistyczny na TrkB niż związek macierzysty 7,8-DHF i jego działanie stymulujące utrzymuje się również dłużej u zwierząt.
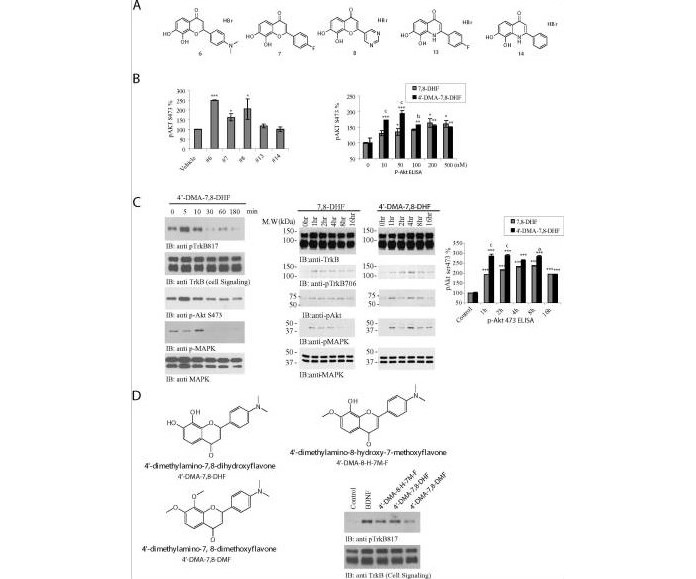 (A) Struktury chemiczne różnych pochodnych 7,8-DHF. (B) Test Phospho-Akt ELISA przez syntetyczne związki w neuronach korowych. Pierwotne hodowle korowe z zarodków szczurzych E17 potraktowano 500 nM różnych pochodnych 7,8-DHF. Lizaty komórkowe analizowano testem ELISA (lewy panel) (*: P<0,05, ***: P<0,001 vs nośnik, test t-Studenta). Różne dawki 4'-DMA-7,8-DHF i 7,8-DHF inkubowano z pierwotnymi neuronami korowymi przez 15 minut. Lizaty komórkowe (20 μg) analizowano za pomocą testu p-Akt ELISA (prawy panel) (*: P<0,05, **: P<0,01, ***: P<0,001 vs kontrola, jednoczynnikowa ANOVA; b: P <0,01, c: P<0,001 vs 7,8-DHF w tym samym stężeniu, test t-Studenta). Dane pochodziły z 2 zestawów powtórzonych eksperymentów (średnia ± SEM). (C) Test przebiegu w czasie z 4'-DMA-7,8-DHF. Szczurze pierwotne neurony traktowano 500 nM 4'-DMA-7,8-DHF w różnych punktach czasowych. Lizaty neuronalne analizowano z różnymi przeciwciałami. 4'-DMA-7,8-DHF szybko aktywował TrkB i jego dalsze kaskady sygnalizacyjne (lewe panele). 4'-DMA-7,8-DHF ujawnił dłuższy okres aktywacji TrkB w mózgu myszy. 1 mg/kg 4'-DMA-7,8-DHF i 7,8-DHF podawano doustnie myszom C57 BL/6J, a fosforylację TrkB i jej dalsze kaskady sygnalizacyjne, w tym Akt i MAPK w mózgu myszy, analizowano metodą immunoblottingu w różne punkty czasowe. Aktywacja TrkB przez 4'-DMA-7,8-DHF osiągnęła szczyt po 4 godzinach, podczas gdy maksymalna aktywacja TrkB przez 7,8-DHF w mózgu myszy wystąpiła po 1–2 godzinach (panele środkowe). Analizowano test ELISA P-Akt 4734 w mózgu myszy leczonych lekiem (prawy panel) (***: P<0,001 vs kontrola, jednoczynnikowa ANOVA; a: P<0,05, c: P<0,001 vs 7,8-DHF w takie samo stężenie, test t-Studenta). Dane pochodziły z 2 zestawów powtórzonych eksperymentów (średnia ± SEM). (D) Grupy 7,8-dihydroksylowe są niezbędne dla agonistycznego działania flawonu. Różne pochodne zastąpione metoksy testowano na neuronach pierwotnych za pomocą testów immunoblottingu.
(A) Struktury chemiczne różnych pochodnych 7,8-DHF. (B) Test Phospho-Akt ELISA przez syntetyczne związki w neuronach korowych. Pierwotne hodowle korowe z zarodków szczurzych E17 potraktowano 500 nM różnych pochodnych 7,8-DHF. Lizaty komórkowe analizowano testem ELISA (lewy panel) (*: P<0,05, ***: P<0,001 vs nośnik, test t-Studenta). Różne dawki 4'-DMA-7,8-DHF i 7,8-DHF inkubowano z pierwotnymi neuronami korowymi przez 15 minut. Lizaty komórkowe (20 μg) analizowano za pomocą testu p-Akt ELISA (prawy panel) (*: P<0,05, **: P<0,01, ***: P<0,001 vs kontrola, jednoczynnikowa ANOVA; b: P <0,01, c: P<0,001 vs 7,8-DHF w tym samym stężeniu, test t-Studenta). Dane pochodziły z 2 zestawów powtórzonych eksperymentów (średnia ± SEM). (C) Test przebiegu w czasie z 4'-DMA-7,8-DHF. Szczurze pierwotne neurony traktowano 500 nM 4'-DMA-7,8-DHF w różnych punktach czasowych. Lizaty neuronalne analizowano z różnymi przeciwciałami. 4'-DMA-7,8-DHF szybko aktywował TrkB i jego dalsze kaskady sygnalizacyjne (lewe panele). 4'-DMA-7,8-DHF ujawnił dłuższy okres aktywacji TrkB w mózgu myszy. 1 mg/kg 4'-DMA-7,8-DHF i 7,8-DHF podawano doustnie myszom C57 BL/6J, a fosforylację TrkB i jej dalsze kaskady sygnalizacyjne, w tym Akt i MAPK w mózgu myszy, analizowano metodą immunoblottingu w różne punkty czasowe. Aktywacja TrkB przez 4'-DMA-7,8-DHF osiągnęła szczyt po 4 godzinach, podczas gdy maksymalna aktywacja TrkB przez 7,8-DHF w mózgu myszy wystąpiła po 1–2 godzinach (panele środkowe). Analizowano test ELISA P-Akt 4734 w mózgu myszy leczonych lekiem (prawy panel) (***: P<0,001 vs kontrola, jednoczynnikowa ANOVA; a: P<0,05, c: P<0,001 vs 7,8-DHF w takie samo stężenie, test t-Studenta). Dane pochodziły z 2 zestawów powtórzonych eksperymentów (średnia ± SEM). (D) Grupy 7,8-dihydroksylowe są niezbędne dla agonistycznego działania flawonu. Różne pochodne zastąpione metoksy testowano na neuronach pierwotnych za pomocą testów immunoblottingu.
Aby ilościowo porównać antyapoptotyczną aktywność tych dwóch agonistów TrkB, przygotowano neurony korowe i wstępnie potraktowano komórki różnymi wskazanymi stężeniami 4'-DMA-7,8-DHF i 7,8-DHF przez 30 min, a następnie 50 μM glutaminianu przez 16 godz. Lizaty komórkowe analizowano ilościowo za pomocą testu ELISA z aktywną kaspazą-3. Prowokowana glutaminianem aktywacja kaspazy-3 była zasadniczo blokowana przez oba związki w stężeniach 50 nM lub wyższych. Jednak przy 10 nM 4'-DMA-7,8-DHF wykazywał silniejsze działanie hamujące niż 7,8-DHF (Figura 4A i B). Wyniki te pasują do statusu aktywacji receptora TrkB przez 4'-DMA-7,8-DHF i 7,8-DHF (Figura 3B). Aby zbadać, czy związki te wywierają jakiekolwiek działanie neuroochronne u zwierząt, przeprowadzono test przebiegu w czasie. Test miareczkowania ujawnił, że 7,8-DHF indukowało aktywację TrkB w sposób zależny od dawki po podaniu doustnym (rysunek uzupełniający 3). Poprzednie badanie sugerowało, że 7,8-DHF wykazuje silne działanie neuroprotekcyjne w dawce 5 mg/kg4. W związku z tym podawano oba związki (5 mg/kg) doustnie przez zgłębnik. W 0 godz., 2 godz. lub 6 godz. podawano dootrzewnowo kwas kainowy (KA) (20 mg/kg). Po 2 godzinach uśmiercono myszy i przygotowano regiony hipokampa. Immunoblotting z lizatami mózgu myszy wykazał, że aktywacja kaspazy-3 indukowana przez KA była nieznacznie zmniejszona z upływem czasu, co jest odwrotnie skorelowane z aktywacją TrkB przez 4'-DMA-7,8-DHF (Figura 4C, lewe panele). Niemniej jednak aktywacja kaspazy-3 indukowana przez KA została zmniejszona o 7,8-DHF po 4 godzinach, a aktywna kaspaza-3 nieznacznie wzrosła po 8 godzinach. To widmo kinetyczne jest ściśle powiązane ze stanem aktywacji TrkB przez 7,8-DHF (Figura 4C, prawy panel).
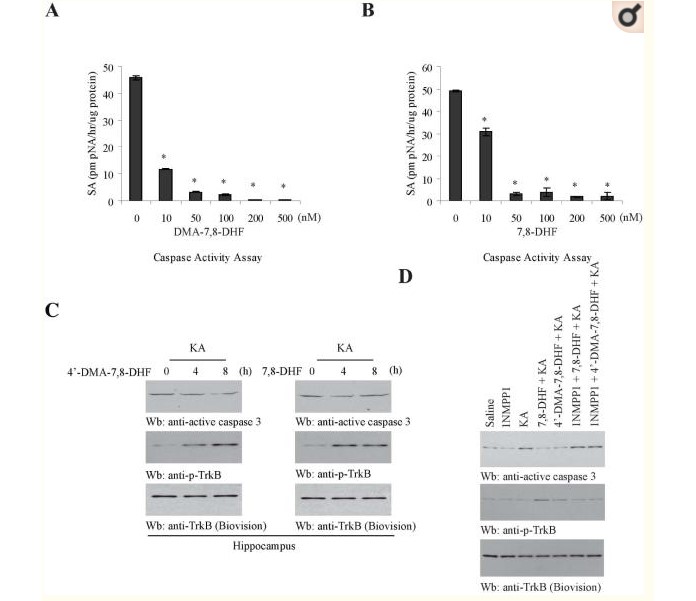
4'-dimetyloamino-7,8-dihydroksyflawon zapobiega apoptozie neuronów w sposób zależny od TrkB (A i B)
Test ELISA na aktywną kaspazę-3. Neurony korowe przygotowano z embrionów szczura E16. Neurony wstępnie potraktowano różnymi dawkami związków, jak wskazano, przez 30 min, a następnie 50 μM glutaminianu przez 16 godzin. Lizaty komórkowe analizowano testem ELISA z aktywną kaspsą-3. (C) 4'-DMA-7,8-DHF i 7,8-DHF zapobiegają wywoływanej przez KA śmierci komórek nerwowych. Myszom C57BL/6J podawano doustnie 5 mg/kg 4'-DMA-7,8-DHF i 7,8-DHF, w różnych punktach czasowych, myszom podawano i.p. wstrzyknięto 20 mg/kg KA przez 2 godziny. Lizaty mózgowe analizowano za pomocą immunoblottingu odpowiednio z przeciwciałami anty-p-TrkB, anty-aktywna kaspaza-3. (D) Aktywacja TrkB jest niezbędna dla neuroprotekcyjnego działania 4'-DMA-7,8-DHF. 4'-DMA-7,8-DHF i 7,8-DHF hamowały indukowaną przez KA aktywację kaspazy-3 u myszy knockin z mutacją TrkB F616A, której nie można zablokować za pomocą 1NMPP1 (górny panel). TrkB F616A był silnie aktywowany przez 4'-DMA-7,8-DHF i 7,8-DHF, który był blokowany przez 1NMPP1 (środkowy panel).
Podawanie monoaminowych leków przeciwdepresyjnych o charakterze przewlekłym, ale nie ostrym, wzmaga neurogenezę u dorosłych w zakręcie zębatym gryzoni i naczelnych innych niż człowiek, podczas gdy blokowanie neurogenezy przez napromienianie osłabia behawioralne działanie tych leków podobne do leków przeciwdepresyjnych u niektórych szczepów gryzoni14-17. Sugeruje to, że dla skuteczności leków przeciwdepresyjnych wymagana jest wzmożona neurogeneza hipokampa u dorosłych. Ablacja TrkB specyficznie w neuronalnych komórkach progenitorowych hipokampa zapobiega przewlekłej neurogenezie indukowanej antydepresantami i sprawia, że myszy nie reagują behawioralnie na przewlekłe leczenie antydepresantami10. Aby sprawdzić, czy zwiększenie aktywacji TrkB przez tych małych agonistów podniesie neurogenezę, podano albo nośnik, 7,8-DHF i 4'-DMA-7,8-DHF (5 mg/kg), doustnie przez zgłębnik dorosłemu samcowi C57BL /6J myszy przez 21 dni. Pod koniec leczenia (dzień 21), zwierzętom wstrzyknięto BrdU (50 mg/kg, dootrzewnowo (i.p.)) w celu znakowania dzielących się komórek i uśmiercono 2 godziny później. Następnie zastosowano immunohistochemię BrdU do oceny proliferacji komórek progenitorowych (Figura 5A). Zaobserwowano, że długotrwałe (21 dni) leczenie agonistami TrkB znacząco zwiększyło neurogenezę w porównaniu z kontrolą nośnika. Barwienie immunohistochemiczne wykazało, że TrkB był wyraźnie aktywowany przez te dwie substancje chemiczne w zakręcie zębatym (Figura 5B) po 3 tygodniach leczenia. Dlatego przewlekłe leczenie agonistami TrkB promuje neurogenezę w hipokampie myszy.
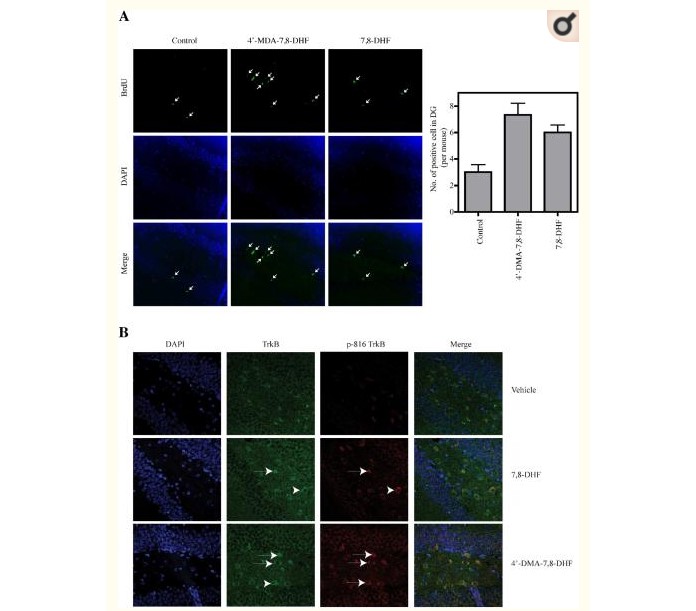 4'-dimetyloamino-7,8-dihydroksyflawon i 7,8-dihydroksyflawon promują neurogenezę
4'-dimetyloamino-7,8-dihydroksyflawon i 7,8-dihydroksyflawon promują neurogenezę
A, Test neurogenezy. Samcom myszy C57BL/6J podawano doustnie 5 mg/kg 4'-DMA-7,8-DHF i 7,8-DHF oraz rozpuszczalnik nośnika przez 21 dni, a następnie 50 mg/kg BrdU i.p. zastrzyk. Po 2 godzinach myszy poddano perfuzji, a skrawki mózgu wybarwiono immunologicznie anty-BrdU i DAPI. Pozytywne komórki w zakręcie zębatym zaznaczono strzałką (lewe panele). Analiza ilościowa komórek BrdU dodatnich w zakręcie zębatym (prawy panel). B, 7,8-DHF i jego pochodna zwiększają aktywację TrkB w zakręcie zębatym. Skrawki parafinowe odparafinowano w ksylenie i uwodnionym gradientowym roztworze etanolu. Próbki gotowano w 10 mM buforze cytrynianu sodu przez 20 minut w celu odzyskania antygenu. Skrawki mózgu inkubowano z anty-TrkB (BD Biosciences, San Jose, CA) 1:50 i zastosowano anty-p-TrkB Y816 w rozcieńczeniu 1:300. Przeciwciało drugorzędowe zastosowano przy użyciu przeciwciał anty-króliczych Alexa 594 (czerwony), anty-mysi-FITC (zielony). Do barwienia jądra zastosowano DAPI (niebieski).
Coraz więcej dowodów potwierdza, że BDNF odgrywa zasadniczą rolę w pośredniczeniu w terapeutycznych skutkach antydepresantów8, 9, 19, 20. Infuzja egzogennego BDNF do hipokampa lub pnia mózgu ma działanie behawioralne podobne do antydepresantów21, 22. Test wymuszonego pływania jest szeroko stosowany do badanie przesiewowe potencjalnych leków przeciwdepresyjnych i jest szeroko stosowane do pomiaru aktywności przeciwdepresyjnej23, 24. Aby zbadać, czy 4'-DMA-7,8-DHF i 7,8-DHF mają jakiekolwiek działanie przeciwdepresyjne, takie jak BDNF, przeprowadzono test wymuszonego pływania po przewlekłym leczenie myszy przez 21 dni przez podawanie doustne. Gdy myszom podawano 7,8-DHF (5 mg/kg), bezruch podczas pływania był znacznie zmniejszony. Co ciekawe, 4'-DMA-7,8-DHF (5 mg/kg) również wyraźnie zmniejszał bezruch (Figura 6A), co sugeruje, że 7,8-DHF i jego pochodna imitują BDNF i wywierają silne działanie przeciwdepresyjne. Analiza immunoblottingu wykazała, że oba związki ewidentnie prowokowały TrkB, ale nie aktywację TrkA w mózgu myszy (Figura 6B).
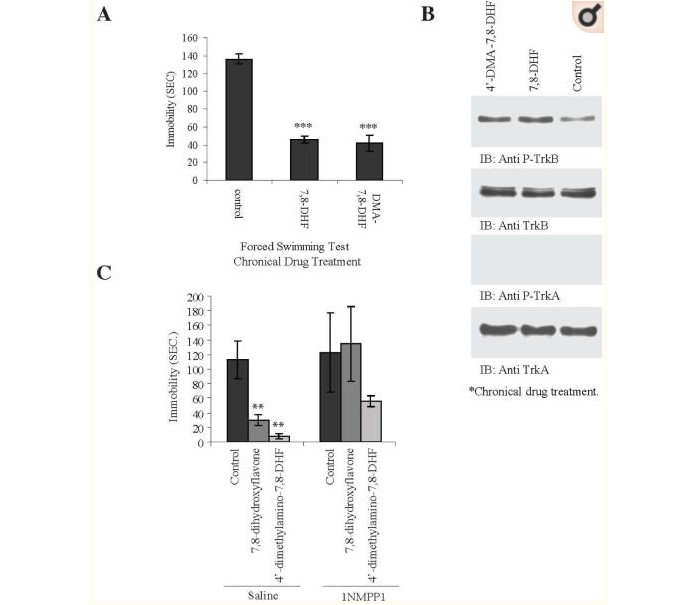 4'-dimetyloamino-7,8-dihydroksyflawon i 7,8-dihydroksyflawon wykazują działanie przeciwdepresyjne w sposób zależny od TrkB
4'-dimetyloamino-7,8-dihydroksyflawon i 7,8-dihydroksyflawon wykazują działanie przeciwdepresyjne w sposób zależny od TrkB
(A) Test wymuszonego pływania ze związkami 4'-DMA-7,8-DHF i 7,8-DHF. Samcom myszy C57BL/6J (8 myszy/grupę) podawano doustnie przez zgłębnik 5 mg/kg 4'-DMA-7,8-DHF i 7,8-DHF oraz roztwór soli fizjologicznej nośnika przez 21 dni i poddano wymuszonemu działaniu test pływania (6 min, bezruch zarejestrowany w ciągu ostatnich 4 min). Dane przedstawiono jako średnią ± SEM. Analiza wariancji (ANOVA) wykazała istotną różnicę między nośnikiem a 7,8-DHF lub 4'-DMA-7,8-DHF (n=6, ***P<0,0001 w porównaniu z nośnikiem). (B) TrkB, ale nie TrkA, jest aktywowane przez 4'-DMA-7,8-DHF i 7,8-DHF w mózgu myszy. Lizaty mózgowe z powyżej przewlekle leczonych myszy analizowano metodą immunoblottingu z anty-p-TrkA 794 i p-TrkB 817. (C) Test wymuszonego pływania z myszami knockin TrkB F616A. Samcom myszy TrkB knockin podano zwykłą wodę pitną lub 1NMPP1 (25 μM) zawierającą wodę pitną na jeden dzień przed rozpoczęciem wstrzykiwania leków i kontynuowano przez cały eksperyment. Wskazaną kontrolę (sól fizjologiczna) i leki podawano przez 5 dni. Dane przedstawiono jako średnie ± SEM; Analiza wariancji (ANOVA) wykazała istotny wpływ pomiędzy nośnikiem a 7,8-DHF (n=7 myszy, **P<0,001) lub 4'-DMA-7,8-DHF (**P<0,001) w TrkB Myszy KI. Żaden z leków nie powodował znaczącej zmiany u myszy TrkB KI leczonych 1NMPP1 (n=6 do 7 myszy) w porównaniu z kontrolą.
Aby ocenić, czy w reakcjach behawioralnych 7,8-DHF i jego pochodnej pośredniczy receptor TrkB, wykorzystano myszy TrkB F616A knockin. Myszy transgeniczne poddano odpowiednio wstępnemu działaniu soli fizjologicznej lub 1NMPP1. Nie zaobserwowano znaczącej różnicy w czasie bezruchu między grupami kontrolnymi, którym podawano sól fizjologiczną i 1NMPP1. W grupie solanki, zarówno 7,8-DHF, jak i 4'-DMA-7,8-DHF znacznie skróciły czas bezruchu; przeciwnie, ani 4'-DMA-7,8-DHF, ani 7,8-DHF nie miały żadnego istotnego wpływu na czas bezruchu po leczeniu 1NMPP1 (Figura 6C), co sugeruje, że hamowanie kaskady sygnalizacyjnej TrkB blokuje działanie przeciwdepresyjne przez TrkB agoniści. Zatem dane te pokazują, że 4'-DMA-7,8-DHF i jego macierzysty ołów naśladują BDNF i działają jako silne leki przeciwdepresyjne u myszy poprzez aktywację receptora TrkB.
Źródło: Xia Liu,1 Chi-Bun Chan,1 Sung-Wuk Jang,1 Sompol Pradoldej,1 Junjian Huang "A Synthetic 7,8-Dihydroxyflavone Derivative Promotes Neurogenesis and Exhibits Potent Antidepressant Effect" J Med Chem. Author manuscript; available in PMC 2012 May 12.
PRODUKT NIE DO SPOŻYCIA PRZEZ LUDZI.
Ten produkt nie jest suplementem diety na terenie Polski. Informacje zawarte w opisach nie są zatwierdzone przez GIF, GIS oraz EFSA i nie mają na celu leczenia, diagnozowania lub zapobiegania jakiejkolwiek chorobie.
Cytowane badania naukowe nie mogą być uważane za jednoznaczne z uwagi na ich ograniczony charakter i nie muszą ujawniać pełnego spektrum działania substancji.
Opinie klientów zawarte w kartach produktów nie są opiniami ekstrakty.com oraz nie mogą być uznawane za zalecenia do ich stosowania. Ekstrakty.com nie bierze odpowiedzialności za informacje w nich zawarte.
Zawsze skonsultuj się z lekarzem lub farmaceutą podczas stosowania nowego środka nootropowego. Obsługujemy tylko osoby pełnoletnie i nie bierzemy odpowiedzialności za niewłaściwe stosowanie zakupionych produktów.
Dokładamy wszelkich starań by opis właściwości, działanie, dawkowanie, zastosowanie produktów oraz cena były wykonane możliwie rzetelnie i precyzyjnie. Nasz sklep to nie apteka, dzięki czemu masz prawo do zwrotu nieotwartego produktu bez podania przyczyny w ciągu 30 dni.
Zaloguj sie